
Axit Oxalic: Định Nghĩa, Ứng Dụng, Tác Hại và Lưu Ý Quan Trọng
05 Tháng 12, 2023
Trong thế giới hóa học, axit oxalic là một hợp chất quen thuộc với nhiều ứng dụng đa dạng trong cả công nghiệp và đời sống hàng ngày. Tuy nhiên, đi kèm với những lợi ích đó là những tác hại tiềm ẩn nếu không được sử dụng đúng cách. Việc tìm hiểu kỹ lưỡng về acid oxalic không chỉ giúp chúng ta khai thác tối đa những ưu điểm của nó mà còn bảo vệ sức khỏe, môi trường xung quanh. Vậy axit oxalic là gì? Nó có những tính chất đặc biệt nào? Ứng dụng của nó trong các lĩnh vực khác nhau ra sao?, quan trọng nhất, chúng ta cần lưu ý những gì để sử dụng oxalic một cách an toàn, hiệu quả? Hãy cùng Hóa Chất Gia Hoàng khám phá tất tần tật về hợp chất thú vị này trong bài viết dưới đây.
1. Định nghĩa và tính chất của Axit Oxalic
Axit Oxalic là gì? Axit Oxalic hay còn được biết đến với tên gọi hóa học là axit ethanedioic một hợp chất hóa học hữu cơ có công thức là HOOC-COOH hoặc C₂H₂O₄. Đây là một axit cacboxylic, nghĩa là trong cấu trúc phân tử của nó có chứa hai nhóm carboxyl (-COOH). Acid oxalic được coi là một trong những axit hữu cơ đơn giản nhất, mạnh nhất. Sự hiện diện của hai nhóm carboxyl này quyết định phần lớn các tính chất hóa học đặc trưng.
Công thức hóa học: (COOH)₂ hoặc C₂H₂O₄.
Công thức này cho thấy mỗi phân tử Axit Oxalic bao gồm 2 nguyên tử cacbon, 2 nguyên tử hydro, 4 nguyên tử oxy. Dạng ngậm nước phổ biến của nó là acid oxalic dihydrat, có công thức C₂H₂O₄·2H₂O.
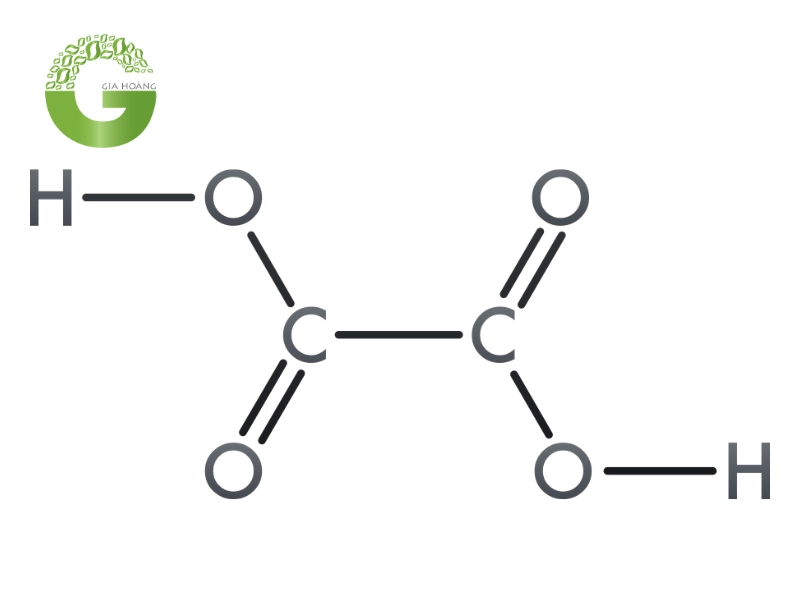
Công thức hóa học của Axit Oxalic
Tính chất vật lý:
- Trạng thái: Ở điều kiện thường, oxalic tồn tại ở dạng tinh thể không màu hoặc bột màu trắng. Những tinh thể này thường dễ hút ẩm từ không khí.
- Độ tan trong nước và các dung môi khác: Axit Oxalic tan tốt trong nước (khoảng 90-100 g/L ở 20°C). Độ tan tăng lên đáng kể khi nhiệt độ tăng. Nó cũng tan trong các dung môi phân cực khác như ethanol, ether, nhưng ít tan trong các dung môi không phân cực như benzen hay chloroform. Ví dụ, ở 25°C, độ tan của oxalic trong ethanol là 237 g/L và trong diethyl ether là 14g/L.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Acid oxalic khan (dạng không ngậm nước) có nhiệt độ nóng chảy khoảng 189.5°C (373.1°F), bị phân hủy khi đun nóng tiếp. Dạng dihydrat (C₂H₂O₄·2H₂O) có nhiệt độ nóng chảy thấp hơn, khoảng 101.5°C (214.7°F), khi đó nó mất nước kết tinh. Acid oxalic thăng hoa ở khoảng 157°C.

Tính chất hóa học của acid oxalic giúp loại bỏ vết gỉ sét của kim loại
Tính chất hóa học:
-
Tính axit: Do có hai nhóm cacboxyl, oxalic là một axit tương đối mạnh so với các axit cacboxylic khác. Nó mạnh hơn axit axetic khoảng 10.000 lần. Axit oxalic phản ứng bazơ để tạo thành muối oxalat, nước.Ví dụ:
- (COOH)₂ + 2 NaOH → (COONa)₂ + 2H₂O (Phản ứng giữa oxalic, natri hydroxit tạo thành natri oxalat, nước).
- (COOH)₂ + Zn → Zn(COO)₂ + H₂↑ (Phản ứng giữa oxalic, kẽm tạo thành kẽm oxalat, khí hydro).
-
Tính khử: Axit Oxalic, các muối oxalat hoạt động như một chất khử mạnh, đặc biệt trong môi trường axit. Nó có khả năng khử các chất oxy hóa mạnh như kali permanganat (KMnO₄) và các hợp chất của crom (VI).
- Phản ứng giữa acid oxalic, kali pemanganat trong môi trường axit sunfuric là một phản ứng chuẩn độ oxy hóa-khử phổ biến. Trong phản ứng này, ion permanganat màu tím (MnO₄⁻) bị khử thành ion mangan(II) không màu (Mn²⁺), trong khi oxalic bị oxy hóa thành khí carbon dioxide (CO₂). Phản ứng này thường được sử dụng để xác định nồng độ của dung dịch KMnO₄ hoặc oxalic. Phản ứng như sau: 5(COOH)₂ + 2KMnO₄ + 3H₂SO₄ → K₂SO₄ + 2MnSO₄ + 10CO₂ + 8H₂O
-
Phản ứng tạo phức với kim loại: Anion oxalat (C₂O₄²⁻) là một ligand hai càng (bidentate ligand) tuyệt vời, khả năng tạo phức chất bền vững với nhiều ion kim loại. Khả năng này đóng vai trò quan trọng trong nhiều ứng dụng của oxalic, chẳng hạn như tẩy rỉ sét (phức với Fe³⁺) hoặc trong phân tích hóa học.
- Ion Fe³⁺ tạo phức [Fe(C₂O₄)₃]³⁻ với ion oxalat. Sự hình thành phức này giúp hòa tan các hợp chất sắt không tan, giải thích tại sao oxalic hiệu quả trong việc loại bỏ vết rỉ sét.
2. Ứng dụng của Axit Oxalic
Nhờ những tính chất hóa học đa dạng, oxalic và các dẫn xuất của nó như muối oxalat, nhiều ứng dụng quan trọng trong các ngành công nghiệp, đời sống. Công ty Hóa Chất Gia Hoàng tự hào là nhà cung cấp oxalic chất lượng cao, đáp ứng nhu cầu đa dạng của bạn.

Các ứng dụng đa dạng của Axit Oxalic trong nhiều lĩnh vực
Trong công nghiệp dệt may:
- Tẩy trắng vải: Axit Oxalic được sử dụng như một chất tẩy trắng hiệu quả cho vải, len, các loại sợi tự nhiên khác, đặc biệt là để loại bỏ các vết ố vàng hoặc các vết bẩn do kim loại gây ra. Nó hoạt động bằng cách phản ứng các ion kim loại gây màu, chuyển chúng thành các phức chất không màu, dễ rửa trôi. Ví dụ, trong ngành công nghiệp giặt là, oxalic được dùng để xử lý các vết rỉ sét trên quần áo.
- Sử dụng làm chất cầm màu (mordant): Trong quá trình nhuộm vải, oxalic được sử dụng như một chất cầm màu, giúp thuốc nhuộm bám chắc hơn vào sợi vải, làm tăng độ bền màu của sản phẩm. Nó giúp tạo ra các liên kết hóa học giữa thuốc nhuộm, sợi vải.
Trong công nghiệp tẩy rửa:
- Tẩy rỉ sét: Đây là một trong những ứng dụng phổ biến nhất của acid oxalic. Nhờ khả năng tạo phức mạnh với ion sắt (III), acid oxalic hòa tan rỉ sét (chủ yếu là oxit sắt) một cách hiệu quả. Các sản phẩm tẩy rỉ sét thương mại thường chứa oxalic làm thành phần chính. Ví dụ, để làm sạch các dụng cụ kim loại bị rỉ, người ta ngâm chúng trong dung dịch acid oxalic.
- Làm sạch các bề mặt kim loại: Axit Oxalic được dùng để làm sạch, đánh bóng các bề mặt kim loại như đồng, thau, thép không gỉ. Nó cũng được sử dụng để làm sạch đá cẩm thạch, các loại đá tự nhiên khác, loại bỏ các vết bẩn, khôi phục độ bóng. Ví dụ, trong ngành công nghiệp đóng tàu, acid oxalic được dùng để làm sạch vỏ tàu.
Trong y học:
- Sản xuất thuốc: Mặc dù oxalic tinh khiết có độc tính, một số dẫn xuất của nó được sử dụng trong tổng hợp dược phẩm. Ví dụ, oxaliplatin, một loại thuốc hóa trị liệu ung thư, có chứa một phối tử oxalat.
- Sử dụng trong một số xét nghiệm: Trong phòng thí nghiệm y tế, acid oxalic hoặc muối oxalat (như kali oxalat) được sử dụng làm chất chống đông máu cho các mẫu máu dùng trong xét nghiệm huyết học, bằng cách tạo phức với ion canxi trong máu, ngăn cản quá trình đông máu.
Trong nông nghiệp:
- Loại bỏ các ion kim loại trong nước: Axit oxalic được sử dụng để xử lý nước, loại bỏ các ion kim loại nặng không mong muốn thông qua việc tạo phức, kết tủa.
- Điều chỉnh độ pH của đất: Mặc dù ít phổ biến hơn, trong một số trường hợp, acid oxalic được xem xét để điều chỉnh độ pH của đất kiềm, tuy nhiên cần thận trọng do ảnh hưởng của nó đến canxi trong đất.
- Một ứng dụng đặc biệt trong ngành nuôi ong là sử dụng acid oxalic để kiểm soát ve Varroa, một loại ký sinh trùng gây hại nghiêm trọng cho ong mật. Phương pháp này được coi là một giải pháp hữu cơ, hiệu quả.
Các ứng dụng khác:
- Trong phòng thí nghiệm: Axit oxalic là một thuốc thử quan trọng trong hóa học phân tích, dùng để chuẩn độ dung dịch kali pemanganat, kết tủa canxi, các kim loại đất hiếm.
- Trong sản xuất giấy: Axit oxalic được sử dụng trong quá trình sản xuất bột giấy để tẩy trắng bột giấy, cải thiện độ sáng của giấy.
- Trong xử lý gỗ: Dung dịch oxalic được dùng để tẩy các vết ố đen trên gỗ do nước hoặc kim loại gây ra, giúp phục hồi màu sắc tự nhiên của gỗ.
- Trong nhiếp ảnh: Ferrioxalat, một phức chất của sắt, oxalat, được sử dụng trong một số quy trình nhiếp ảnh cổ điển như cyanotype.
3. Tác hại của Axit Oxalic
Bên cạnh những ứng dụng hữu ích, Axit Oxalic cũng là một hợp chất có độc tính, gây hại cho sức khỏe con người nếu không được sử dụng, xử lý đúng cách. Việc hiểu rõ những tác hại này là vô cùng quan trọng để đảm bảo an toàn.
Độc tính của Axit Oxalic:
- Ảnh hưởng đến sức khỏe khi tiếp xúc trực tiếp: Khi tiếp xúc trực tiếp với da hoặc mắt, acid oxalic (đặc biệt ở dạng dung dịch đậm đặc hoặc bột) gây kích ứng mạnh, bỏng rát, đỏ, sưng, tổn thương mô. Hít phải bụi oxalic gây kích ứng đường hô hấp, ho, khó thở, tổn thương niêm mạc.
- Ảnh hưởng đến sức khỏe khi ăn phải: Đây là đường phơi nhiễm nguy hiểm nhất. Nuốt phải acid oxalic hoặc thực phẩm chứa hàm lượng oxalic cao gây ngộ độc cấp tính. Liều gây chết trung bình (LD50) qua đường miệng ở người ước tính khoảng 15-30 gram, tuy nhiên, các triệu chứng ngộ độc nghiêm trọng xảy ra ở liều thấp hơn nhiều, đặc biệt ở trẻ em hoặc những người có vấn đề về thận.
Cơ chế gây độc:
-
Tạo kết tủa với canxi trong cơ thể, gây sỏi thận: Cơ chế gây độc chính của acid oxalic là khả năng tạo liên kết mạnh với ion canxi (Ca²⁺) trong cơ thể, hình thành canxi oxalat (CaC₂O₄) – một hợp chất không tan.
- Khi oxalic được hấp thụ vào máu, nó sẽ phản ứng canxi trong máu, làm giảm nồng độ canxi huyết thanh. Tình trạng hạ canxi máu cấp tính gây ra các vấn đề nghiêm trọng về tim mạch, thần kinh cơ.
- Canxi oxalat không tan sau đó được lọc qua thận, kết tinh trong ống thận, đường tiết niệu, gây tắc nghẽn, tổn thương thận cấp tính, hình thành sỏi thận (sỏi canxi oxalat là loại sỏi thận phổ biến nhất). Một nghiên cứu đăng trên "New England Journal of Medicine" đã chỉ ra mối liên hệ giữa việc tiêu thụ lượng lớn thực phẩm giàu oxalat, nguy cơ hình thành sỏi thận.
- Gây kích ứng da, mắt, đường hô hấp: Do tính axit mạnh, oxalic có tác dụng ăn mòn, gây kích ứng trực tiếp lên các mô mà nó tiếp xúc. Nó phá hủy lớp màng bảo vệ của tế bào, gây viêm, hoại tử.

Ảnh hưởng đến sức khỏe nếu tiếp xúc acid oxalic trực tiếp
Triệu chứng ngộ độc: Các triệu chứng ngộ độc acid oxalic xuất hiện nhanh chóng sau khi phơi nhiễm, mức độ nghiêm trọng phụ thuộc vào liều lượng, đường tiếp xúc:
- Tiêu hóa: Cảm giác nóng rát ở miệng, cổ họng, đau bụng dữ dội, buồn nôn, nôn mửa, tiêu chảy.
- Toàn thân: Yếu cơ, co giật (do hạ canxi máu), rối loạn nhịp tim, tụt huyết áp.
- Thận: Đau lưng (vùng thận), tiểu ít hoặc vô niệu (do suy thận cấp).
- Hô hấp: Ho, khó thở, đau ngực, phù phổi nếu hít phải.
- Tiếp xúc da/mắt: Đau rát, đỏ, bỏng, tổn thương mô.
Cách xử lý khi bị nhiễm độc: Đây là tình huống khẩn cấp y tế, cần được xử lý nhanh chóng:
-
Sơ cứu ban đầu:
- Nếu nuốt phải: Không gây nôn trừ khi có chỉ định của nhân viên y tế (do nguy cơ gây bỏng thêm đường tiêu hóa). Cho nạn nhân uống ngay một lượng lớn sữa hoặc nước để pha loãng, trung hòa một phần acid oxalic (canxi trong sữa kết hợp với oxalat). Dùng các chất chứa canxi như canxi gluconat hoặc canxi clorua dạng uống nếu có sẵn, được hướng dẫn.
- Nếu hít phải: Đưa nạn nhân ra khỏi khu vực ô nhiễm, đến nơi thoáng khí. Nếu khó thở, cần hỗ trợ hô hấp.
- Nếu tiếp xúc với da: Cởi bỏ quần áo bị nhiễm hóa chất. Rửa sạch vùng da bị ảnh hưởng bằng nhiều nước trong ít nhất 15-20 phút.
- Nếu tiếp xúc với mắt: Rửa mắt ngay lập tức bằng dòng nước sạch chảy nhẹ trong ít nhất 15-20 phút, giữ mí mắt mở rộng.
- Đến cơ sở y tế gần nhất để được điều trị: Cần đưa nạn nhân đến bệnh viện càng sớm càng tốt. Điều trị y tế bao gồm việc theo dõi, điều chỉnh nồng độ canxi máu, hỗ trợ chức năng sống (hô hấp, tuần hoàn), điều trị tổn thương thận, các biến chứng khác.
Nhiều nghiên cứu đã tập trung vào mối liên hệ giữa việc tiêu thụ acid oxalic từ thực phẩm, nguy cơ hình thành sỏi thận. Một nghiên cứu của Đại học Harvard theo dõi hàng chục ngàn người trong nhiều năm đã chỉ ra rằng những người có tiền sử sỏi thận nên hạn chế thực phẩm giàu oxalat. Các nghiên cứu khác cũng khám phá độc tính tế bào của axit oxalic, ảnh hưởng của nó đến chức năng thận ở cấp độ phân tử.

Sơ cứu nhanh chóng và đưa đến cơ sở y tế gần nhất khi phát hiện các triệu chứng ngộ độc axit oxalic
Xem thêm: Gốc axit là gì? Tính chất, ứng dụng và cách nhận biết
4. Nguồn gốc của Axit Oxalic
Axit Oxalic không chỉ là một sản phẩm của quá trình tổng hợp hóa học, mà còn tồn tại tự nhiên trong nhiều loại thực vật. Việc hiểu rõ về nguồn gốc của nó giúp chúng ta có cái nhìn toàn diện hơn về hợp chất này.

Acid oxalic có trong nhiều loại thực vật
Trong tự nhiên:
- Có trong nhiều loại thực vật: Acid oxalic, muối oxalat của nó được tìm thấy tự nhiên trong nhiều loại thực vật. Đây là một sản phẩm của quá trình trao đổi chất của thực vật. Hàm lượng oxalic khác nhau đáng kể tùy thuộc vào loài thực vật, bộ phận của cây (lá thường chứa nhiều hơn thân hoặc củ), điều kiện sinh trưởng, độ chín.
-
Một số thực vật chứa hàm lượng acid oxalic cao bao gồm:
- Rau bina (rau chân vịt): Đây là một trong những thực phẩm chứa hàm lượng oxalat cao nhất.
- Lá cây đại hoàng: Phần lá của cây đại hoàng rất giàu oxalic, độc, không nên ăn. Phần cuống lá hàm lượng thấp hơn, sử dụng làm thực phẩm nhưng cần lưu ý.
- Khế: Đặc biệt là khế chua, chứa lượng oxalat đáng kể.
- Sắn (khoai mì): Cả lá, củ sắn đều chứa oxalic.
- Me: Quả me cũng là một nguồn acid oxalic.
- Các loại khác: Củ cải đường, cacao, các loại hạt (hạnh nhân, hạt điều), đậu, một số loại quả mọng.
- Hàm lượng acid oxalic trong các loại thực phẩm khác nhau: Hàm lượng oxalic trong thực vật thay đổi tùy thuộc vào giống cây, điều kiện canh tác, độ chín, bộ phận của cây. Việc nấu chín làm giảm một phần hàm lượng oxalat hòa tan trong nước.
Điều chế trong công nghiệp: Axit oxalic được sản xuất trên quy mô lớn trong công nghiệp bằng một số phương pháp hóa học:
-
Từ natri format: Đây là một trong những phương pháp phổ biến. Natri format (HCOONa) được đun nóng đến khoảng 360°C để tạo ra natri oxalat ((COONa)₂), sau đó natri oxalat được xử lý bằng axit sunfuric (H₂SO₄) để giải phóng acid oxalic.
2HCOONa → (COONa)₂ + H₂
(COONa)₂ + H₂SO₄ → (COOH)₂ + Na₂SO₄ -
Từ ethylene glycol: Oxy hóa etylen glycol (HOCH₂CH₂OH) bằng axit nitric (HNO₃) hoặc hỗn hợp axit nitric, axit sunfuric với sự có mặt của xúc tác vanadium pentoxide (V₂O₅) cũng là một phương pháp sản xuất oxalic.
HOCH₂CH₂OH + 2O₂ → (COOH)₂ + 2H₂O - Oxy hóa carbohydrate: Trước đây, axit oxalic cũng được sản xuất bằng cách oxy hóa các carbohydrate như đường mía, tinh bột bằng axit nitric.
Bảng thống kê hàm lượng axit oxalic trong một số loại thực phẩm phổ biến (mg/100g thực phẩm tươi):
|
Thực phẩm |
Hàm lượng Oxalat (mg/100g) |
|
Rau bina (sống) |
970 |
|
Đại hoàng (lá) |
500 - 1200 (rất cao, độc) |
|
Đại hoàng (cuống) |
275 - 750 |
|
Khế |
80 - 730 (tùy độ chua) |
|
Củ cải đường (lá) |
610 |
|
Củ cải đường (củ) |
10 - 30 |
|
Sô cô la đen |
117 |
|
Hạnh nhân |
400 - 490 |
|
Khoai lang |
56 - 280 |
|
Đậu phộng |
187 |
Lưu ý: Các giá trị này là ước tính và có thể thay đổi.
Xem thêm: Axit Trong Chanh Là Axit Gì? Tác Dụng Đối Với Sức Khỏe
5. Điều chế Axit Oxalic

Điều chế axit oxalic trong phòng thí nghiệm và trong công nghiệp
Việc điều chế Axit oxalic được thực hiện cả trong quy mô phòng thí nghiệm cho mục đích nghiên cứu, tổng hợp nhỏ, lẫn trong quy mô công nghiệp lớn để đáp ứng nhu cầu thị trường. Các phương pháp điều chế dựa trên các phản ứng hóa học đặc trưng của các tiền chất.
Trong phòng thí nghiệm:
- Oxy hóa đường bằng axit nitric: Đây là một phương pháp cổ điển, thường được sử dụng trong phòng thí nghiệm để điều chế một lượng nhỏ axit oxalic. Đường sucrose (C₁₂H₂₂O₁₁) hoặc glucose (C₆H₁₂O₆) được đun nóng với axit nitric đặc, thường có thêm một ít vanadi pentoxit (V₂O₅) làm chất xúc tác. Phản ứng oxy hóa mạnh mẽ này sẽ chuyển hóa đường thành acid oxalic. Phản ứng như sau: C₁₂H₂₂O₁₁ + 18[O] (từ HNO₃) → 6(COOH)₂ + 5H₂O
- Thủy phân dicyan: Dicyan ((CN)₂) khi được thủy phân trong môi trường axit hoặc kiềm tạo ra Axit oxalic hoặc muối oxalat. Phản ứng: (CN)₂ + 4H₂O → (COOH)₂ + 2NH₃
Trong công nghiệp: Oxy hóa ethylene glycol hoặc propylene: Quá trình này thường sử dụng axit nitric làm chất oxy hóa, kết hợp không khí, chất xúc tác vanadi. Ethylene glycol bị oxy hóa qua nhiều giai đoạn để tạo thành axit oxalic. Phản ứng như sau: HOCH₂CH₂OH + 2O₂ → (COOH)₂ + 2H₂O
Sơ đồ quy trình điều chế axit oxalic trong công nghiệp từ ethylene glycol:
- Nguyên liệu: Ethylene glycol, axit nitric, không khí, chất xúc tác (V₂O₅).
- Phản ứng oxy hóa: Etylen glicol và axit nitric được đưa vào lò phản ứng chứa chất xúc tác. Không khí được thổi qua để cung cấp oxy. Phản ứng diễn ra ở nhiệt độ, áp suất được kiểm soát.
- Tách sản phẩm: Hỗn hợp sau phản ứng chứa acid oxalic, nước, axit nitric dư, các oxit nitơ.
- Kết tinh và tinh chế: Dung dịch được làm nguội để acid oxalic kết tinh. Các tinh thể acid oxalic sau đó được tách ra bằng cách ly tâm hoặc lọc, rồi được rửa, sấy khô để thu được sản phẩm tinh khiết, thường ở dạng acid oxalic dihydrat (C₂H₂O₄·2H₂O).
- Thu hồi và tái chế: Các oxit nitơ (NOx) sinh ra trong quá trình được thu hồi, tái chế thành axit nitric để giảm thiểu ô nhiễm, chi phí.
-
Phản ứng giữa natri fomat và natri hydroxit (quy trình hai bước từ natri format):
- Tạo natri oxalat: Natri format được nung nóng để tạo natri oxalat.
- Chuyển hóa thành canxi oxalat: Natri oxalat phản ứng canxi hydroxit.
- Axit hóa tạo Axit oxalic: Canxi oxalat phản ứng axit sunfuric. Đây là một trong những quy trình sản xuất acid oxalic quy mô lớn và hiệu quả về mặt chi phí.
Trong bài viết này, chúng ta đã cùng nhau khám phá những khía cạnh quan trọng của axit oxalic, từ định nghĩa, tính chất, ứng dụng, tác hại, nguồn gốc cho đến các phương pháp điều chế. Axit oxalic là một hợp chất hóa học đa năng, nhiều ứng dụng trong các ngành công nghiệp khác nhau, nhưng đồng thời cũng tiềm ẩn những nguy cơ đối với sức khỏe nếu không được sử dụng đúng cách.
Để tìm hiểu thêm thông tin về axit oxalic, bạn tham khảo các nguồn uy tín như sách giáo khoa hóa học, các trang web chuyên ngành về hóa chất, hoặc các bài báo khoa học được công bố trên các tạp chí uy tín. Hóa Chất Gia Hoàng luôn khuyến khích bạn tìm hiểu kỹ thông tin trước khi sử dụng bất kỳ hóa chất nào, để đảm bảo an toàn cho bản thân, cộng đồng. Hy vọng rằng bài viết này đã cung cấp cho bạn những kiến thức hữu ích về axit oxalic. Nếu bạn có bất kỳ câu hỏi nào, xin vui lòng liên hệ với Hóa Chất Gia Hoàng để được tư vấn, hỗ trợ. Xin cảm ơn bạn đã quan tâm theo dõi!
THÔNG TIN LIÊN HỆ:
CÔNG TY TNHH THƯƠNG MẠI DỊCH VỤ XUẤT NHẬP KHẨU GIA HOÀNG
- Địa chỉ: 33/111 Tô Ký, Phường Tân Chánh Hiệp, Quận 12, TP. Hồ Chí Minh
- VPGD: 33/B4 Tô Ký, Phường Tân Chánh Hiệp, Quận 12, TP. Hồ Chí Minh
- Email: hoangkimthangmt@gmail.com
- Website: https://ghgroup.com.vn
- Hotline: 0916047878

