
Gốc axit là gì? Tính chất, ứng dụng và cách nhận biết
17 Tháng 12, 2024
- 1. Gốc axit là gì?
- 2. Phân loại gốc axit gồm những gì?
- 2.1. Gốc axit có hydro
- 2.2. Gốc axit không có hydro
- 3. Tính chất hóa học của axit
- 3.1. Axit làm đổi màu giấy quỳ tím
- 3.2. Axit tác dụng với kim loại
- 3. 3. Axit tác dụng với bazơ
- 3.4. Axit tác dụng với oxit bazơ
- 3.5. Axit tác dụng với muối
- 5. Ứng dụng của một số axit
- 5.1. Lĩnh vực công nghiệp
- 5.2. Công nghệ thực phẩm
- 5.3. Lĩnh vực y tế
- 5.4. Trong cơ thể người
- 6. Cách nhận biết Gốc Axit
Trong lĩnh vực cung cấp hóa chất, việc hiểu rõ các khái niệm cơ bản như gốc axit là điều cần thiết để ứng dụng hiệu quả trong công nghiệp, công nghệ thực phẩm, y tế và nhiều lĩnh vực khác. Gốc axit không chỉ là một phần quan trọng trong các phản ứng hóa học mà còn đóng vai trò nền tảng trong việc nghiên cứu và phát triển các sản phẩm hóa chất. Vậy gốc axit là gì? Làm thế nào để phân loại và nhận biết chúng? Hãy cùng GH Group, chuyên gia hàng đầu trong lĩnh vực hóa chất, khám phá chi tiết về chủ đề này qua bài viết dưới đây.
1. Gốc axit là gì?
Gốc axit là phần còn lại của phân tử axit sau khi nó đã mất đi một hoặc nhiều nguyên tử hydro (H⁺) trong nhóm -OH thuộc nhóm chức axit. Đây là thành phần quan trọng trong các phản ứng hóa học liên quan đến axit, đặc biệt là khi axit tham gia vào quá trình tạo muối hoặc phản ứng với bazơ, kim loại, và các hợp chất khác.
Đặc điểm của gốc axit:
Gốc axit thường chứa các nguyên tố như oxy (O), lưu huỳnh (S), clo (Cl), nitơ (N), và các nguyên tố phi kim khác.
Ví dụ:
- Gốc axit của axit clohydric (HCl) là Cl⁻.
- Gốc axit của axit sunfuric (H₂SO₄) là HSO₄⁻ hoặc SO₄²⁻ (tùy thuộc vào số nguyên tử hydro bị mất).
Tính chất: Gốc axit có khả năng kết hợp với các ion kim loại hoặc ion bazơ để tạo thành muối. Tính chất này làm cho gốc axit trở thành một phần quan trọng trong các phản ứng hóa học.
Phân loại: Gốc axit được phân loại dựa trên việc nó còn chứa hydro hay không, bao gồm:
- Gốc axit có hydro: Chứa ít nhất một nguyên tử hydro có thể tiếp tục ion hóa, ví dụ: HSO₄⁻.
- Gốc axit không có hydro: Không còn nguyên tử hydro nào có thể ion hóa, ví dụ: SO₄²⁻.
2. Phân loại gốc axit gồm những gì?

Phân loại gốc axit có hydro và không có hydro
2.1. Gốc axit có hydro
Gốc axit có hydro là gốc axit vẫn còn chứa ít nhất một nguyên tử hydro có khả năng ion hóa. Điều này có nghĩa là gốc axit này vẫn có thể tham gia vào các phản ứng hóa học để giải phóng thêm ion H⁺.
Đặc điểm:
- Gốc axit này thường xuất hiện trong các axit đa chức, tức là axit có nhiều hơn một nguyên tử hydro trong phân tử.
- Loại gốc này có tính chất lưỡng tính, vừa có thể phản ứng như một axit vừa có thể phản ứng như một bazơ trong một số trường hợp.
Ví dụ:
- Gốc HSO₄⁻: Đây là gốc axit có hydro của axit sunfuric (H₂SO₄). Nó vẫn có thể giải phóng thêm một ion H⁺ để tạo thành gốc SO₄²⁻.
- Gốc H₂PO₄⁻: Đây là gốc axit có hydro của axit photphoric (H₃PO₄). Nó có thể tiếp tục ion hóa để tạo thành HPO₄²⁻ hoặc PO₄³⁻.
Ứng dụng: Gốc axit có hydro thường xuất hiện trong các phản ứng trung hòa từng phần, chẳng hạn như khi axit mạnh phản ứng với một lượng bazơ không đủ để trung hòa hoàn toàn.
2.2. Gốc axit không có hydro
Gốc axit không có hydro là gốc axit không còn chứa bất kỳ nguyên tử hydro nào có khả năng ion hóa. Đây là dạng cuối cùng của gốc axit sau khi toàn bộ các nguyên tử hydro đã bị loại bỏ trong quá trình ion hóa.
Đặc điểm:
- Loại gốc này thường mang điện tích âm lớn hơn (ví dụ: SO₄²⁻, PO₄³⁻).
- Gốc axit không có hydro chỉ có khả năng phản ứng như một ion âm, thường kết hợp với các ion dương (cation) để tạo thành muối.
Ví dụ:
- Gốc SO₄²⁻: Đây là gốc axit không có hydro của axit sunfuric (H₂SO₄).
- Gốc PO₄³⁻: Đây là gốc axit không có hydro của axit photphoric (H₃PO₄).
- Gốc NO₃⁻: Đây là gốc axit không có hydro của axit nitric (HNO₃).
Ứng dụng: Gốc axit không có hydro thường được sử dụng trong các phản ứng tạo muối và là thành phần quan trọng trong nhiều hợp chất hóa học như phân bón, chất tẩy rửa và các sản phẩm công nghiệp.
Xem thêm: Axit glutamic: Khái niệm, tính chất và ứng dụng
3. Tính chất hóa học của axit
3.1. Axit làm đổi màu giấy quỳ tím

Axit làm đổi màu quỳ tím
Hiện tượng: Khi nhúng giấy quỳ tím vào dung dịch axit, giấy quỳ tím sẽ chuyển sang màu đỏ. Đây là một trong những cách đơn giản và phổ biến nhất để nhận biết sự có mặt của axit trong dung dịch.
Nguyên nhân: Axit giải phóng ion H⁺ trong dung dịch, làm thay đổi pH của môi trường. Sự thay đổi pH này tác động đến chất chỉ thị màu trong giấy quỳ tím, khiến nó chuyển sang màu đỏ.
Ví dụ:
- Dung dịch axit clohydric (Hóa chất HCl) làm giấy quỳ tím chuyển đỏ.
- Dung dịch axit sunfuric (H₂SO₄ 98% ) cũng tạo ra hiện tượng tương tự.
3.2. Axit tác dụng với kim loại
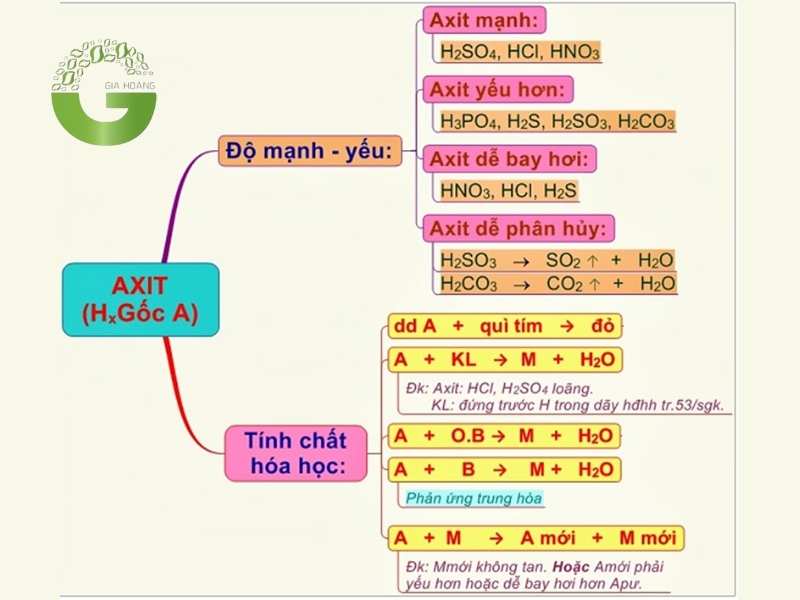
Axit tác dụng với kim loại để tạo ra các phản ứng
Phản ứng: Axit phản ứng với một số kim loại (đứng trước hydro trong dãy hoạt động hóa học) để tạo thành muối và giải phóng khí hydro (H₂).
Phương trình tổng quát: Kimloại+Axit→Muối +H2 ↑
Ví dụ:
- Kẽm (Zn) phản ứng với axit clohydric: Zn+2HCl→ZnCl2 +H2↑
- Sắt (Fe) phản ứng với axit sunfuric loãng: Fe+H2SO4→FeSO4 +H2↑
Ứng dụng: Phản ứng này được sử dụng để sản xuất khí hydro trong phòng thí nghiệm và công nghiệp.
3. 3. Axit tác dụng với bazơ

Khi axit tác dụng với bazo
Phản ứng: Axit phản ứng với bazơ để tạo thành muối và nước. Đây là phản ứng trung hòa, một trong những phản ứng quan trọng nhất của axit.
Phương trình tổng quát: Axit+Bazơ→Muối +H2O
Ví dụ:
- Axit clohydric phản ứng với xút vảy natri hydroxide (NaOH): HCl+NaOH→NaCl+H2O
- Axit sunfuric phản ứng với canxi hydroxide (Ca(OH)₂): H2SO4 +Ca(OH)2 →CaSO4 +2H2O
Ứng dụng: Phản ứng này được sử dụng trong xử lý nước thải, sản xuất muối và các hợp chất hóa học khác.
3.4. Axit tác dụng với oxit bazơ

Axit tác dụng với bazo tạo ra muối (Ví dụ như: CuCl2)
Phản ứng: Axit phản ứng với oxit bazơ để tạo thành muối và nước. Đây là một phản ứng quan trọng trong hóa học vô cơ.
Phương trình tổng quát: Axit+Oxitbazơ→Muối + H2O
Ví dụ:
- Axit clohydric phản ứng với oxit đồng (II) (CuO): 2HCl+CuO→CuCl2 +H2O
- Axit nitric (HNO₃) phản ứng với oxit kẽm (ZnO):2HNO3+ZnO→Zn(NO3)2 +H2O
Ứng dụng: Phản ứng này được sử dụng để sản xuất muối từ các oxit kim loại.
3.5. Axit tác dụng với muối

Axit tác dụng với muối
Phản ứng: Axit có thể phản ứng với muối để tạo thành muối mới và axit mới. Phản ứng này xảy ra khi axit mạnh đẩy axit yếu ra khỏi muối hoặc khi sản phẩm tạo thành có chất kết tủa hoặc bay hơi.
Phương trình tổng quát: Axit1 +Muối →Muối 2 + Axit 2
Ví dụ:
- Axit clohydric phản ứng với natri cacbonat (Na₂CO₃): 2HCl+Na2CO3→2NaCl+H2O+CO2↑
- Axit sunfuric phản ứng với bari clorua (BaCl₂): H2SO4 +BaCl2 →BaSO4↓+2HCl (BaSO₄ là chất kết tủa màu trắng không tan trong nước.)
Ứng dụng: Phản ứng này được sử dụng trong sản xuất phân bón, xử lý nước thải và các ứng dụng công nghiệp khác.
5. Ứng dụng của một số axit
5.1. Lĩnh vực công nghiệp
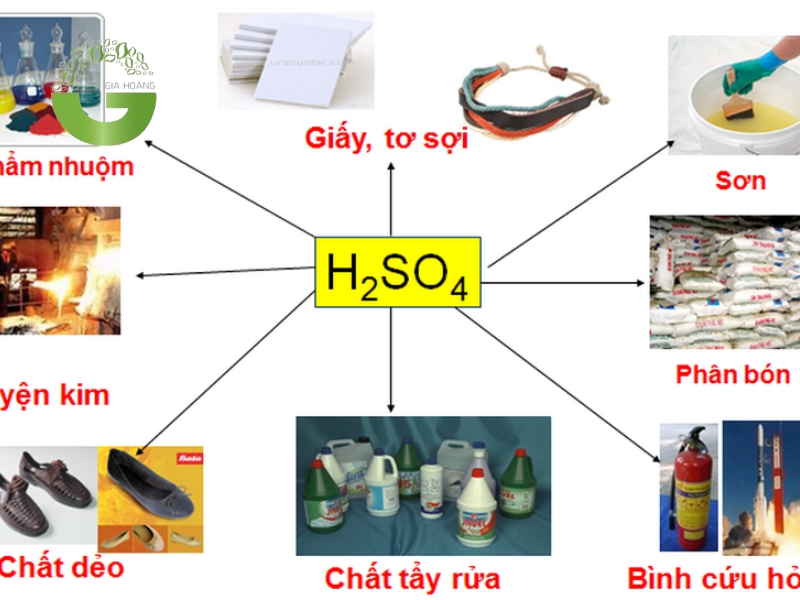
Ứng dụng của axit trong công nghiệp
Trong công nghiệp, các loại axit được sử dụng rộng rãi để sản xuất nhiều sản phẩm và phục vụ các quy trình quan trọng:
- Axit sunfuric (H₂SO₄): Được mệnh danh là "vua của các hóa chất công nghiệp", axit sunfuric được sử dụng để sản xuất phân bón (như superphosphate và ammonium sulfate), chất tẩy rửa, và trong quá trình tinh chế dầu mỏ. Ngoài ra, nó còn được dùng trong sản xuất pin axit chì (ắc quy) và xử lý kim loại.
- Axit nitric (HNO₃): Sử dụng để sản xuất phân bón nitrat, thuốc nổ (như TNT), và các hợp chất hữu cơ khác. Axit nitric cũng được dùng để khắc axit trên kim loại và trong công nghệ mạ điện.
- Axit clohydric (HCl): Được sử dụng trong quá trình làm sạch bề mặt kim loại trước khi mạ hoặc hàn. Axit clohydric cũng là thành phần quan trọng trong sản xuất nhựa PVC và các hợp chất hữu cơ khác.
5.2. Công nghệ thực phẩm

Ứng dụng của axit trong công nghệ thực phẩm
Trong ngành công nghệ thực phẩm, axit đóng vai trò quan trọng trong việc bảo quản, tạo hương vị và cải thiện chất lượng sản phẩm:
- Axit axetic (CH₃COOH): Là thành phần chính trong giấm ăn, axit axetic được sử dụng để bảo quản thực phẩm và tạo hương vị chua tự nhiên.
- Axit citric (C₆H₈O₇): Được sử dụng rộng rãi như một chất điều chỉnh độ chua trong nước giải khát, kẹo, và các loại thực phẩm chế biến. Axit citric cũng có vai trò như một chất bảo quản tự nhiên, ngăn chặn sự phát triển của vi khuẩn và nấm mốc.
- Axit photphoric (H₃PO₄): Thường được thêm vào nước ngọt có ga để tạo vị chua và làm tăng độ bền của sản phẩm.
- Axit ascorbic (Vitamin C): Sử dụng như một chất chống oxy hóa để bảo quản thực phẩm và ngăn chặn sự mất màu hoặc hư hỏng.
5.3. Lĩnh vực y tế
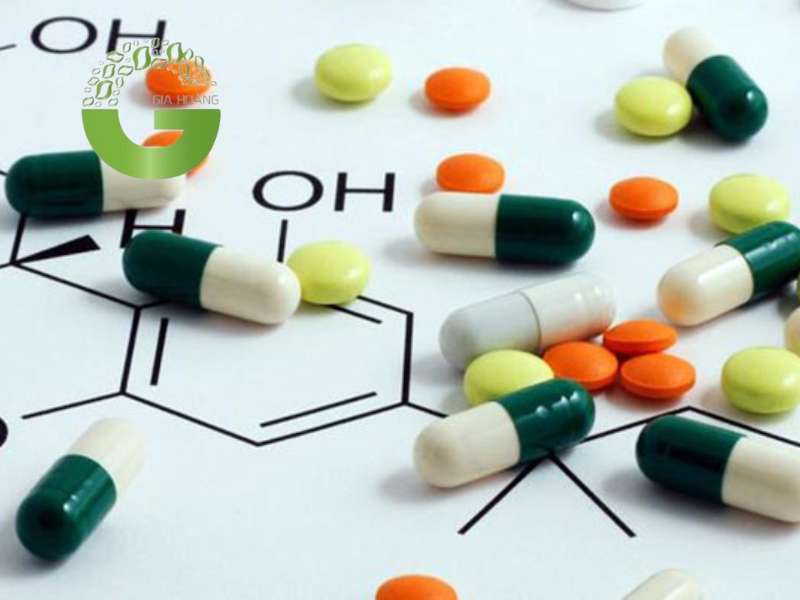
Ứng dụng của axit trong lĩnh vực y tế
Trong y học, axit được sử dụng để điều trị bệnh, sản xuất thuốc và hỗ trợ các quy trình y tế:
- Axit acetylsalicylic (Aspirin): Là một loại thuốc giảm đau, hạ sốt và chống viêm phổ biến, được sử dụng rộng rãi trong y học.
- Axit folic (Vitamin B9): Được khuyến cáo sử dụng cho phụ nữ mang thai để ngăn ngừa dị tật ống thần kinh ở thai nhi.
- Axit clohydric (HCl): Trong y học, axit clohydric được sử dụng để điều chế các loại thuốc và hỗ trợ tiêu hóa khi cơ thể thiếu hụt axit dạ dày.
- Axit lactic: Sử dụng trong các sản phẩm chăm sóc da, giúp tẩy tế bào chết và cải thiện độ đàn hồi của da.
5.4. Trong cơ thể người
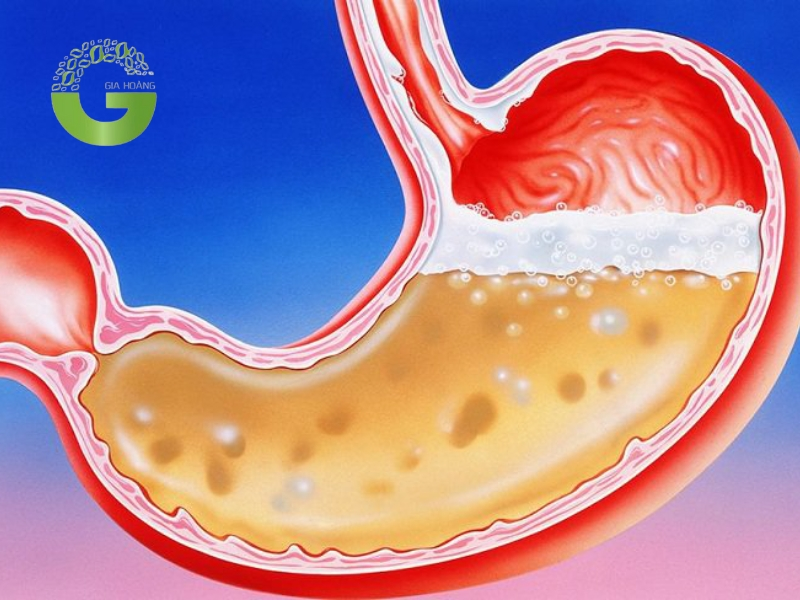
Axit trong cơ thể người
Axit không chỉ tồn tại trong môi trường bên ngoài mà còn đóng vai trò quan trọng trong các quá trình sinh học bên trong cơ thể người:
- Axit dạ dày (HCl): Axit clohydric trong dạ dày giúp tiêu hóa thức ăn bằng cách phá vỡ protein và tiêu diệt vi khuẩn có hại.
- Axit nucleic (DNA và RNA): Là thành phần cấu tạo nên vật chất di truyền, axit nucleic đóng vai trò quan trọng trong việc lưu trữ và truyền tải thông tin di truyền.
- Axit amin: Là thành phần cấu tạo nên protein, axit amin tham gia vào hầu hết các quá trình sinh học trong cơ thể, từ xây dựng cơ bắp đến sản xuất enzyme và hormone.
- Axit lactic: Được sản sinh trong quá trình hoạt động cơ bắp, axit lactic giúp cung cấp năng lượng tức thời cho cơ thể. Tuy nhiên, tích tụ quá nhiều axit lactic có thể gây mỏi cơ.
6. Cách nhận biết Gốc Axit
Dựa vào công thức hóa học
Một cách đơn giản để nhận biết gốc axit là dựa vào công thức hóa học của nó. Gốc axit thường được biểu diễn bằng các ký hiệu hóa học, bao gồm các nguyên tố và số oxi hóa, giúp phân biệt chúng với các ion khác.
-
Nguyên tắc nhận biết:
- Gốc axit thường chứa các nguyên tố phi kim như oxy (O), lưu huỳnh (S), clo (Cl), nitơ (N), hoặc photpho (P).
- Gốc axit có thể mang điện tích âm (-) và được xác định bởi số oxi hóa của nguyên tố trung tâm.
-
Ví dụ minh họa:
- Gốc SO₄²⁻: Là gốc axit của axit sunfuric (H₂SO₄), trong đó lưu huỳnh (S) có số oxi hóa +6.
- Gốc NO₃⁻: Là gốc axit của axit nitric (HNO₃), trong đó nitơ (N) có số oxi hóa +5.
- Gốc PO₄³⁻: Là gốc axit của axit photphoric (H₃PO₄), trong đó photpho (P) có số oxi hóa +5.
Nhận biết qua công thức hóa học là cách nhanh chóng để xác định gốc axit, đặc biệt trong các bài toán hóa học.
Dựa vào bảng gốc axit
Một cách khác để nhận biết gốc axit là tham khảo bảng gốc axit thường gặp. Bảng này liệt kê các gốc axit phổ biến cùng với tên gọi và công thức hóa học của chúng, giúp bạn dễ dàng tra cứu và so sánh.
Bảng gốc axit thường gặp:
|
Tên gốc axit |
Công thức hóa học |
Nguồn gốc từ axit |
|
Sunfat |
SO₄²⁻ |
Axit sunfuric (H₂SO₄) |
|
Nitrat |
NO₃⁻ |
Axit nitric (HNO₃) |
|
Photphat |
PO₄³⁻ |
Axit photphoric (H₃PO₄) |
|
Cacbonat |
CO₃²⁻ |
Axit cacbonic (H₂CO₃) |
|
Clorua |
Cl⁻ |
Axit clohydric (HCl) |
|
Axetat |
CH₃COO⁻ |
Axit axetic (CH₃COOH) |
|
Hidrosunfat |
HSO₄⁻ |
Axit sunfuric (H₂SO₄) |
|
Hidrophotphat |
H₂PO₄⁻ |
Axit photphoric (H₃PO₄) |
Khi gặp một ion âm trong phản ứng hóa học, bạn có thể tra cứu bảng này để xác định gốc axit tương ứng.
Dựa vào phản ứng hóa học
Một số gốc axit có thể được nhận biết thông qua phản ứng đặc trưng với các chất khác, đặc biệt là axit mạnh. Những phản ứng này thường tạo ra sản phẩm dễ quan sát, như khí, kết tủa hoặc thay đổi màu sắc.
Ví dụ minh họa:
- Gốc cacbonat (CO₃²⁻): Phản ứng với axit clohydric (HCl) tạo ra khí CO₂: CO 32−+2H +→H2O+CO2↑
- Hiện tượng: Xuất hiện bọt khí CO₂.
- Gốc sunfat (SO₄²⁻): Phản ứng với dung dịch bari clorua (BaCl₂) tạo kết tủa trắng BaSO₄: SO42−+Ba2+ →BaSO4↓
- Hiện tượng: Xuất hiện kết tủa trắng không tan.
- Gốc nitrat (NO₃⁻): Khi đun nóng với đồng (Cu) và axit sunfuric đặc (H₂SO₄), tạo ra khí NO₂ màu nâu đỏ: NO 3− +Cu+H2SO4 →NO2↑+CuSO4+H2O
- Ứng dụng: Các phản ứng này thường được sử dụng trong phòng thí nghiệm để xác định gốc axit trong các mẫu hóa chất.
Qua bài viết này, chúng ta đã cùng tìm hiểu chi tiết về gốc axit, từ khái niệm, phân loại, tính chất hóa học đến ứng dụng thực tiễn trong nhiều lĩnh vực như công nghiệp, thực phẩm, y tế và cơ thể người. Hiểu rõ về gốc axit không chỉ giúp bạn nắm vững kiến thức hóa học mà còn mở ra nhiều cơ hội ứng dụng trong nghiên cứu và sản xuất.
Tại GH Group, chúng tôi tự hào là đơn vị hàng đầu trong lĩnh vực cung cấp hóa chất, bao gồm các loại axit và hợp chất hóa học chất lượng cao, đáp ứng mọi nhu cầu từ nghiên cứu khoa học đến sản xuất công nghiệp. Với đội ngũ chuyên gia giàu kinh nghiệm và sự cam kết về chất lượng, chúng tôi luôn sẵn sàng hỗ trợ bạn trong việc lựa chọn sản phẩm phù hợp và tối ưu hóa quy trình sử dụng.
Nếu bạn đang tìm kiếm nguồn cung cấp hóa chất đáng tin cậy hoặc cần tư vấn chuyên sâu, hãy liên hệ ngay với Hóa chất Gia Hoàng. Chúng tôi cam kết mang đến giải pháp toàn diện và dịch vụ tốt nhất để đồng hành cùng sự thành công của bạn.
CÔNG TY TNHH THƯƠNG MẠI DỊCH VỤ XUẤT NHẬP KHẨU GIA HOÀNG
- Địa chỉ: 33/111 Tô Ký, Phường Tân Chánh Hiệp, Quận 12, TP. Hồ Chí Minh
- VPGD: 33/B4 Tô Ký, Phường Tân Chánh Hiệp, Quận 12, TP. Hồ Chí Minh
- Email: hoangkimthangmt@gmail.com
- Website: https://ghgroup.com.vn
- Hotline: 0916047878

